“1971 年,Judah Folkman 教授提出 “腫瘤生長和轉移依賴于血管新生” 理論,認為新血管的形成對于腫瘤生長和轉移至關重要。”
腫瘤細胞需要新生血管來提供營養和氧氣,以維持其持續生長和擴散。研究腫瘤細胞的血管生成能力和血管侵襲能力對于了解腫瘤生物學機制,以及發展抗腫瘤治療策略具有重要意義。成血管實驗可以模擬腫瘤微環境,評估腫瘤細胞及其周圍細胞對血管生成的影響。
成血管實驗怎樣設計?
跪求具體實驗 Protocol?
一文走進熱門實驗技術,為發表高分文獻提供新思路,“膠”你做實驗!
TIPS:
l 在成血管前需要饑餓培養細胞,以增加細胞對生長因子和刺激因子的敏感性,促進血管生成。常用于成血管研究的細胞類型有 HUVEC、HMVEC、HMEC-1 等
l 在成血管實驗中通常有對照組與添加促進或抑制血管生成的藥物進行對比,以研究該藥物對腫瘤細胞成血管的影響。
l 一般成血管實驗使用的基質膠濃度建議至少 10mg/mL,更高濃度的基質膠效果會縮短血管開始形成的時間,并且血管形成時間更長,易于確定觀察時間窗口。
前排插播
前排插播
NEST 的 GelNestTM基質膠取自小鼠腫瘤組織,可增強細胞粘附、分化和增殖。它模擬生理環境,是組織工程和細胞培養研究的理想選擇,尤其適用于類器官和干細胞培養。它還有助于癌癥研究,如侵襲、血管生成和體內腫瘤形成實驗。
成血管專用款基質膠濃度在 12-14mg/mL,相比標準款與低因子款更適合用于體外成血管實驗。

材料與方法
材料與方法
Part.01 GelNestTM成血管專用基質膠包被
1. 在 96 孔板的底部均勻鋪上 50μL GelNest?基質膠原液(推薦 211492,濃度>12mg/mL),添加時避免氣泡產生。24 孔每孔約加 280μL,其他孔板按培養面積大小增減。(為防止基質膠粘附在槍頭內壁, 在吸取基質膠前可用槍頭吹吸一次 FBS,對槍頭內壁進行 FBS 潤洗。)
2. 將培養板置于 37℃培養箱 30 至 60 分鐘。若有液體剩余,可用移液槍輕輕吸出。
3. 包被好的培養板請盡快使用。
Part.02 HUVEC細胞培養與成血管
1. 將 HUVEC 細胞培養至 70-80%的匯合度,原代細胞代數應該在 5 代以內。
2. 將完全培養基替換成饑餓細胞用培養基:含 0.2% FBS(減血清)、2mM L-谷氨酰胺、1mM 丙酮酸鈉、100U/mL 青霉素和 100μg/mL 鏈霉素的 DMEM 培養基,饑餓培養 24 小時。
3. 胰酶消化 HUVEC 細胞并進行細胞計數。
4. 將 5x104個 HUVEC 細胞加入含基質膠的 96 孔板的單孔中,每孔體積控制在 200μL。將 96 孔板放入培養箱中進行培養。
5. 血管樣網絡結構預計將在 3 至 12 小時內形成。首次實驗請每隔一小時觀察一次,以防血管結構繼續分化,錯過觀察窗口。
Part.03 染色與觀察
1. 血管樣網絡結構可以直接用相差顯微鏡觀察,也可以用以下步驟進行熒光染色。
2. 小心去除培養基,避免破壞血管結構。加入200μL HBSS緩沖液潤洗兩次,并除去。
3. 加入1/1000濃度的Calcein AM(綠色)培養基進行染色。
4. 使用熒光顯微鏡對細胞進行成像,并記錄分析血管網絡的形態和特征。
實驗結果分析
實驗結果分析
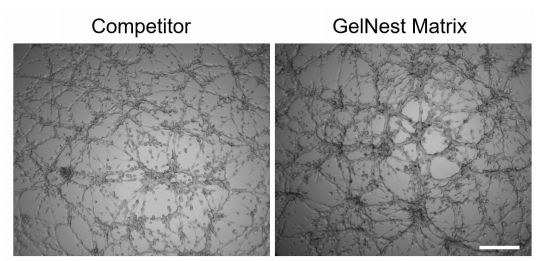
圖 1.HUVEC 細胞分別在競品和本公司(GelNest Matrix)基質膠上培養 9 個小時后形成血管網絡的結果。標尺為 300μm。
可觀察到在 GelNestTM 基質膠中血管樣網絡結構形成良好。
常見問題與解答
常見問題與解答
1. 應該采用何種培養基稀釋基質膠?
建議使用不加雙抗、不加胎牛血清的高糖DMEM培養基稀釋基質膠。
2. 如何使鋪膠更均勻?
槍頭要垂直于內孔的正上方,防止有基質膠流經孔壁殘留。
若是孔的底部沒有鋪滿基質膠,可以晃動一下96孔板,使底部鋪膠均勻。
若還是沒有均勻鋪滿底部,可用槍頭稍微攪動一下。
3. HUVEC必須用專用培養基嗎?能不能用普通培養基?
(1) 若使用普通培養基需要添加生長因子,常見的有ECGF/ECGF,ECGF。
(2) 普通培養基+生長因子的方式價格較貴,建議使用專用ECM內皮專用培養基。
4. HUVEC細胞系換液第二天為何出現空泡化?如何解決空泡化問題?
可能原因:
(1) 培養液的pH值與細胞正常所需pH值差別太大,細胞代謝異常導致空泡化;
(2) 在細胞培養過程中由于血清濃度不夠、藥物作用、外界刺激等情況,導致細胞代謝出現問題,內質網應激導致出現細胞空泡化的情況。
解決方法:
(1)測定完全培養基的pH,看其酸堿性是否適宜。多數細胞適宜的pH范圍為7.2-7.4。
(2)若培養基或血清是已開封且存放了很久,建議使用新鮮的完全培養基給細胞換液;若都是新開封的,建議使用新批次的基礎培養基或血清來配制培養液,給細胞換液并進行觀察。
5. HUVEC培養過程中出現聚團如何處理?
聚團可能是因為培養板親水性差或者血清中的促貼壁因子不足。
解決方法:
(1) 培養瓶使用前一天使用明膠包被。
包被方法:以T25瓶為例,取用5mL明膠放入T25瓶中,37℃放置30分鐘以上,將多余的明膠吸出。
(2) 提高培養液中基質膠濃度。
(3) 使用ECM內皮專用培養基進行配置。
6. 如何判斷加入的基質膠體積是否合適?
在孔板下方放置一張格子紙(如圖),垂直透過每個孔觀察:
(1) 如果觀察到的格子比實際尺寸小,基質膠加入的體積過少;
(2) 如果觀察到的格子比實際尺寸大,基質膠加入的體積過多;
(3) 如果觀察到的格子與實際尺寸一致,基質膠加入的體積適合。

7. 如何解決成管實驗中細胞不能形成連續的網格的問題?
建議使用3-5代狀態較好且融合度70%-80%的HUVEC細胞進行成管試驗,此時的細胞成管能力較強。
在顯微鏡下邊觀察邊使用胰酶消化細胞,當細胞變圓時及時終止消化過程。消化過度會影響成管效果。
盡可能保證細胞數量約為3萬個/孔,細胞數量過少會使細胞無法形成連續的網絡。
選擇低生長因子基質膠進行成管實驗時,可考慮在培養基中添加生長因子,刺激細胞形成網絡狀。
8. 細胞鋪板數量如何確定?
由于計數方式的差異可能導致細胞數量的差異,可進行預實驗測試合適的細胞數鋪板,適宜的細胞數量如下圖:

9. 成管實驗需要幾個小時?小管形成后為何會塌縮?
成管時間與細胞狀態密切相關。細胞狀態好時,2-3小時開始成管,細胞狀態較差時,可能18-24h成管。建議第一次實驗時,每隔一個小時觀察一次。
成管時間取決于培養基中血管生成因子的濃度。腫瘤條件培養基中血管生成因子較豐富,容易成管,而基礎培養基所需要的成管時間較久。
如果使用原代內皮細胞而非永生化細胞,開始成管的時間會延遲數個小時。
小管形成后有塌縮可能是培養時間過久,內皮細胞發生凋亡。
10. 血管形成實驗中使用的凝膠是否需要含酚紅?
對于使用相差顯微鏡,酚紅不會干擾圖片,并且由于其顏色,處理更容易。
然而,當使用熒光顯微鏡時,酚紅可能會干擾探頭的波長。在這種情況下,最好使用無酚紅凝膠。